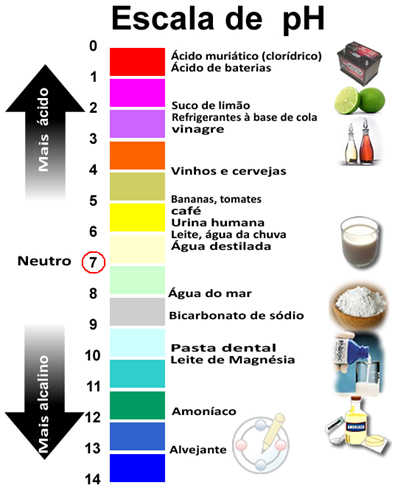
A Teoria de Dalton é uma teoria criada por John Dalton (1766-1844) a qual dizia que a matéria era constituída por corpúsculos extremamente pequenos chamados átomos.
A teoria da matéria ser constituída por átomos já tinha sido proposta/falada por Demócrito há cerca de 2500 anos, tomando valor cientifico com os trabalhos de Dalton.
Actualmente sabe-se que algumas (ou bastantes) das teorias da Teoria de Dalton estão erradas (lembrando que este homem se encontrava no século XIX) mas algumas das teorias da sua Teoria são:
"- Os átomos são indivisíveis;

- Não se criam nem se destroem;
- Sendo do mesmo elemento químico são iguais;
- Diferem de elemento químico para elemento químico (por exemplo se fosse possível ver a olho nu os átomos poderíamos num grupo de Hidrogénio distinguir um átomo de Oxigénio);
- De diferentes elementos químicos combinam-se entre si formando compostos."
[Retirado do livro (CFQ)8 de António José Silva / Cláudia Simões, Fernanda Resende, Manuela Ribeiro]
Mas hoje em dia sabe-se que a matéria (átomos) é constituída por: protões, neutrões, electrões.
Sendo que os átomos tem todos a mesma estrutura, um núcleo extremamente pequeno o qual é constituído por protões e neutrões o qual esta rodeado por uma nuvem electrónica (ou seja os electrões a deslocarem-se a grande velocidade).
Também se sabe que os átomos em si são electricamente neutros (carga 0) como os seus neutrões, mas os seus protões e electrões já tem carga (negativa ou positiva) sendo os protões que se encontram num núcleo com carga positiva e os electrões que tem a carga negativa.
Quando um átomo tem mais electrões ou protões torna-se um ião, sendo que quando o numero de electrões é menor ao de protões é um catião e quando o numero de electrões é maior que o de protões torna-se um anião.
Todos os elementos químicos (átomos) estão escritos numa tabela chamada Tabela Periódica a qual é uma tabela na qual todos os nomes dos elementos conhecidos derivam do seu nome em grego, latim ou inglês.