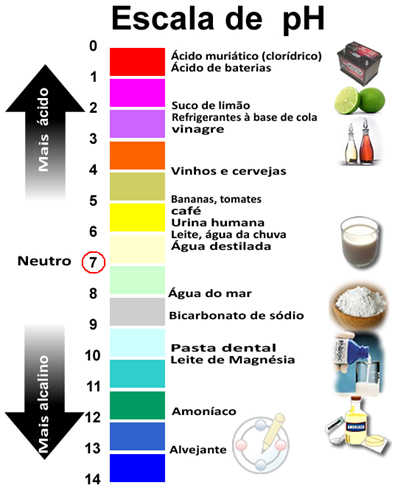
- Ácidos (como o vinagre)
- Básicas ou Alcalinas (pasta de dentes)
- Neutra (água destilada)
Devido a isto, ocorreu a necessidade de poder identificar o caracteres químicos das diferentes soluções, sendo este dado por indicadores ácido-base, os quais são substancias que permitem identificar o carácter químico da solução aquosa através da mudança de cor.
Estes são:
- Azul de tornesol o qual na presença de uma solução ácida torna-a alaranjada, na presença de uma solução neura torna-a arroxeada e o qual na presença de soluções básicas torna-a azul.
- Fenolftalina o qual na presença de soluções acidas e básicas continua incolor enquanto que em soluções básicas se torna rosa-carmim.

Estes não nos indicam a força da solução básica ou acida, o que é uma desvantagem.
Contudo existem outros indicadores de pH mais precisos como o papel universal, o qual é pratico, mas que não é muito preciso e o indicador electrolítico que não é muito prático, mas é muito preciso.


A força do pH é medida através da escala de pH, a qual é uma escala numérica compreendida entre zero e catorze, a 25ºC de temperatura, o qual indica de 7 a 0 a força de acido e de 7 a 14 a força de uma base.
Sem comentários:
Enviar um comentário